Mit KI das menschliche Genom entschlüsseln
Prof. Eleftheria Zeggini erforscht am Helmholtz Institute for Translational Genomics, wie Risiken für komplexe Krankheiten wie Diabetes, Osteoarthritis und Adipositas (der Phänotyp) aus der DNA-Sequenz (der Genotyp) vorhergesagt werden können. Eine solche Vorhersage auf der Grundlage genomischer Daten kann eine frühzeitige Intervention ermöglichen und zur Verhinderung von Komplikationen bei Krankheiten dienen.
Das Sequenzieren der Genome von Tausenden gesunder und erkrankter Personen führt zu riesigen Datenmengen, die ein weitaus größeres Potenzial bieten, als Menschenhände vollständig nutzen können. Computeralgorithmen hingegen verfügen über diese Fähigkeit. Prof. Zeggini und ihr Team verwenden KI-Algorithmen, um Genvarianten in menschlichen Genomen zu identifizieren, die mit Krankheiten assoziiert sind. Darüber hinaus können diese Algorithmen Biomarker identifizieren, die Prognosen für den Krankheitsverlauf und potenzielle Komplikationen liefern. Prof. Zeggini betont, dass diese Informationen nicht deterministisch sind, sondern ein relatives Risiko beinhalten. Ob tatsächlich eine Krankheit ausbricht, hängt von der Wechselwirkung mit verschiedenen Umweltfaktoren ab.
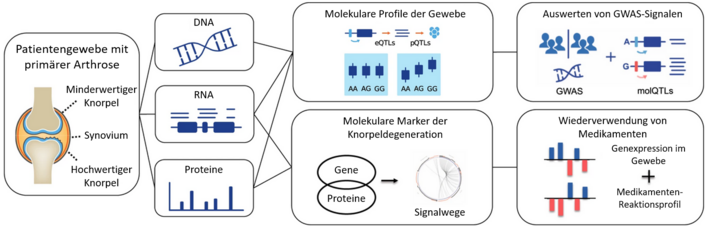
Laut Zeggini hat sich die Kombination von KI und genomischen Daten als sehr hilfreiches Instrument zur Analyse und Neuzweckbestimmung bereits vorhandener Medikamente für verschiedene Krankheitsbilder erwiesen. Das bedeutende Potenzial dieses Ansatzes liegt darin, dass Medikamente schneller eingesetzt werden können, wenn sie sich als wirksam erweisen, da sie bereits auf Sicherheit getestet wurden.
Mit KI genetische Krankheiten diagnostizieren und heilen
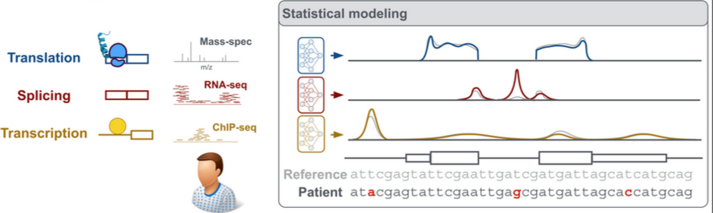
Mutationen in der DNA können Krebs und vererbbare Krankheiten verursachen, was verheerende Folgen haben kann. Das menschliche Genom ist so groß und komplex (3 Milliarden Basenpaare!), dass das Auffinden von krankheitsverursachenden Mutationen eine Herausforderung darstellt. Oftmals betrifft dies nur ein einzelnes Basenpaar. Daher bleiben die genetischen Ursachen von Krebs und vererbbaren Krankheiten häufig unklar und damit auch mögliche Heilungsansätze. Prof. Julien Gagneur und seine Forschungsgruppe am Lehrstuhl für Computational Molecular Medicine der TUM entwickeln Algorithmen, die aus umfangreichen Sequenzdaten Vorhersagen darüber treffen können, wie Mutationen zu fehlerhaften Genprodukten führen.
Dabei sind sie besonders an sogenannten nicht-codierenden DNA Sequenzen interessiert, die mit 98-99% den absoluten Großteil des Genoms darstellen. Diese Sequenzen werden nicht in Proteine übersetzt, spielen jedoch eine entscheidende Rolle als Regulatoren der Expression von Genen, die Proteine codieren. Prof. Gagneur nutzt fortschrittliche KI-Techniken und massive genomische Datenmengen, um die Funktion dieser weit weniger gut erforschten Sequenzen, die den Großteil des Genoms ausmachen, zu verstehen.
Mit KI zelluläre Entwicklung und Funktion verstehen

Aus einer einzelnen befruchteten Eizelle entwickelt sich ein Mensch, der aus ein paar hundert verschiedenen Zelltypen besteht – ein Meisterwerk der Natur.
Prof. Fabian Theis und sein Team am Helmholtz Munich Computational Health Center erforschen, welche molekularbiologischen und biochemischen Prozesse dies vollbringen. Gleichzeitig untersuchen sie, was in kranken Patienten schiefläuft. Um diese Fragen zu beantworten, sequenzieren und charakterisieren sie einzelne Körperzellen. Das produziert Big Data. Um in dieser Datenflut Antworten zu finden, entwickeln sie KI Algorithmen, um die Methode des unüberwachten maschinellen Lernens anzuwenden. Diese Art von KI analysiert Daten ohne eine konkrete Fragestellung und gruppiert Zelltypen basierend auf gemeinsamen Merkmalen, wie zum Beispiel ähnlichen Genexpressionsprofilen. Je ähnlicher sich Zellen sind, desto näher stehen sie sich in einem biologischen Entwicklungsprozess.
Auf diese Art und Weise erstellt KI Modelle, die die Entwicklungsschritte von Zelltypen und Geweben veranschaulichen. Basierend auf solchen Zellatlassen menschlicher Organe lassen sich biochemische Marker identifizieren und zur Diagnose einsetzen, zum Beispiel von Stoffwechselkrankheiten. Darüber hinaus werden sie dazu beitragen, Arzneimittel mit erhöhter Präzision zu entwickeln, die gezielt sehr spezifische Prozesse behandeln und weniger Nebenwirkungen verursachen.
